ATP合酶(又称为F0F1-ATP酶或复合物V),是人体线粒体内最重要的分子机器,负责将生物外界摄入的食物中的能量转化到机体细胞所能利用的能量储存模块ATP分子中去。人体95%的ATP由它所合成。为了解释ATP合酶的工作机理,Paul D. Boyer提出“旋转催化假说”。1994年,英国MRC结构生物学家John Walker通过X射线衍射技术获得了2.8 Å分辨率下的牛心线粒体F1-ATP酶晶体结构(目前《细胞生物学》教材的经典内容),清晰地表明了F1上的3个β亚基的构象明显不同,分别为结合ATP的紧密态、ADP即将释放的开放态以及无底物结合的松散态,从而有力地支持了“旋转催化假说”[1]基于二人的重要贡献,Paul D. Boyer和John Walker共享了1997年诺贝尔化学奖(各占1/4的奖金,另一半奖金由钠钾泵发现者Jens Christian Skou获得)。在近六十年的研究过程中,科学家初步揭开了这一重要分子机器的神秘面纱,普遍认为此类分子机器可以在线粒体内膜形成的脊上以多聚二聚体的形式呈现双排线状排布。但是这一重要分子机器的具体作用机制及调控机制,乃至这一巨大分子机器的亚基组成以及完整结构一直不是很清楚。
2019年6月14日,我校药学院兼职教授、清华大学生命科学学院杨茂君研究团队在Science杂志发表题为Cryo-EM structure of the mammalian ATP synthase tetramer bound with inhibitory protein IF1的研究长文,药学院是共同完成单位。该文突破性地发现并解析了哺乳动物ATP合酶四聚体的构成形式和高分辨率结构。首次获得了高等生物ATP合酶的完整结构,提出了细胞内调控ATP合酶的分子机理,为进一步理解哺乳动物ATP合酶的亚基组成、调控机制、以及其对线粒体形态的影响等提供了重要的结构基础,同时也为以后教科书的更新提供了重要素材。
杨茂君教授自从2008年在清华组建研究团队起,就一直在线粒体呼吸链研究领域深耕,并取得了一系列重要研究成果,首次在原子水平上阐明了线粒体呼吸链超级复合物的结构[2],随后发现了线粒体呼吸链超超级复合物的存在,解析了这一目前世界上所解析的最大也是最复杂的哺乳动物超大膜蛋白分子机器的结构,并部分阐明了它的作用机制[3,4]。
在上述课题的进展过程中,杨茂君团队持续性地发现含量极其稀少的具有H型分子结构的颗粒的存在,进一步地分析表明这些颗粒应该是一种ATP合酶四聚体复合物,对应于之前CN-PAGE中的高分子量条带。随后,设计了一整套全新的、完备的纯化路线,获得了大量高纯度、高均一性的蛋白样品并制备了大量冷冻电镜样品。经过检查后,发现部分样品质量非常好,适合收集数据。
因为该四聚体分子量大约为2.8兆道尔顿,呈现H状分布,体积巨大,数据计算过程中需要大量计算资源。基于此,决定采用一种全新的计算方法,将四聚体中四个ATP合酶分子分别重新居中然后单独挖出来,而将X型中对角线上构象相似的分子合并。最终获得了主要分为两类的大量构象一致的单个ATP合酶的颗粒。在其后的计算中逐步将这两类构象不同的复合物分辨率提高到了原子分辨率水平。6.2 Å分辨率下的整体结构表明两个V形的ATP合酶二聚体近似垂直地排列在一起形成C2对称的结构,其中有六个位点对二聚体聚合成四聚体起主要作用。从这一较低分辨率复合物中提取并解析的3.34和3.45Å分辨率的亚结构则对应于E和DP两个旋转态。两个状态中的亚基是完全相同的,均含有以前研究发现的18种亚基和一个新发现的k亚基(基于酵母的命名方式,氨基酸组成并未鉴定出来)。该结构是目前发现的最完整的哺乳动物ATP合酶结构,两种不同构象的结构不仅能够完美的解释哺乳动物ATP合酶如何合成ATP分子,而且还鉴定了各个亚基在复合物中的位置和功能。
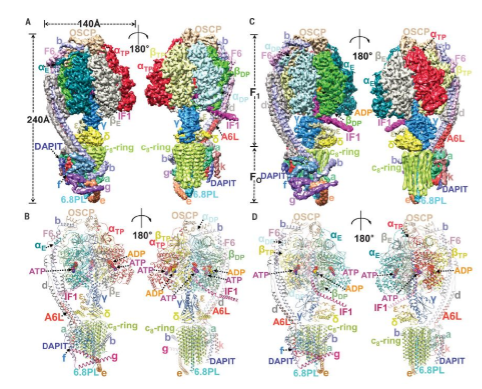
单个ATP合酶分子机器长得跟我们常见的发电机非常类似。在其跨膜区有一个由8个C1亚基构成的类似于发电机线圈的结构,而跨膜区其它亚基共同构成基座稳定这一桶状结构。以往生化研究表明,在线粒体膜间隙和胞质间的线粒体内膜两侧存在巨大的质子浓度差。而这一质子浓度差是由细胞内通过消化食物中所获得的能量分子上的高能电子在通过线粒体电子传递链蛋白复合物最终传递给我们呼吸所吸收的氧气分子上生成水的过程中,逆质子浓度梯度从线粒体胞质中泵到线粒体膜间隙中去的。我们平常呼吸进入体内的氧气大约有90%左右会在这一过程中被消耗掉。线粒体膜间隙的质子会在内膜两侧的质子浓度差所带来的电势的驱动下沿着8个C1亚基形成的桶状结构外圈环绕一圈后流入线粒体基质,质子的流动会带动这一结构在细胞膜内转动进而通过连接的杆状结构驱动基质侧的三个催化活性中心在ADP上添加一个磷酸基团,依次合成ATP分子。每8个质子流过会驱动桶状结构转动一圈,同时会驱动三个活性中心各合成一个ATP分子。有意思的是在酵母中是由10个C1亚基形成的桶状结构,所以需要10个质子流过才能合成3个ATP分子,而植物中是14个C1亚基形成桶状结构,故而合成效率是14个质子流过才能合成3个ATP分子。这说明高等生物中能量的利用率大大提高了。物理学告诉我们,所谓电流就是电子在导线中的同向位移,而电子设备在电流作用下做功。同理,在我们的线粒体中,质子环绕ATP合酶C-ring运动促使其头部做功,合成ATP分子。
基于结构,杨茂君团队发现ATP合酶四聚体很可能被至少三种机制抑制。首先,在线粒体基质一侧,IF1蛋白会将其N端深深的插入到一个ATP合酶具有催化活性的圆形的脑袋中间,跟连接跨膜区和脑袋的杆结合,而其C端会形成一个长的螺旋。最有意思的是这个螺旋会在质子浓度的调节下形成各种不同的聚合状态。当质子浓度升高的时候它会形成二聚体,进而将ATP合酶四聚体中靠近一侧的两个脑袋给拉住,抑制ATP合酶活性中心的运动,从而使其不能合成ATP分子。当质子浓度降低时,IF1蛋白会形成四聚体或者高聚体,从而将其N端从ATP合酶的脑袋中抽出来,解除这种抑制,ATP合酶变成有活性的状态,进而合成ATP。
总之,这一研究成果不仅首次发现、鉴定并解析了线粒体内这一最重要的蛋白超级复合物的完整结构,修正了以往科学发现中的错误认识,为人们深刻理解线粒体是如何合成我们维持生命所必需的能量分子ATP提供了全新的视角,同时也为我们深刻理解线粒体呼吸链相关疾病的预防和治疗打下了良好的基础,该研究将为人类的身体健康带来重大而深远的影响。 (文/黄锐)
参考文献
1. Stock, D., Leslie, A.G.W. and Walker, J.E. (1999) Molecular architecture of the rotary motor in ATP synthase. Science 286, 1700-1705
2. Gu, Jinke et al., (2016). The architecture of the mammalian respirasome. Nature. 537.10.1038/nature19359.
3. Meng, Wu et al., (2016). Structure of Mammalian Respiratory Supercomplex I1III2IV1. Cell. 167. 1598-1609.e10. 10.1016/j.cell.2016.11.012.
4. Guo, Runyu et al,. (2017). Architecture of Human Mitochondrial Respiratory Megacomplex I 2 III 2 IV 2. Cell. 170. 10.1016/j.cell.2017.07.050.