无头精子症(Acephalic spermatozoa syndrome,ASS)是一种非常严重的畸形精子症,具有家族遗传特征,临床表现为精子头、尾分离,男性不育。早在2015年,袁水桥教授在PNAS杂志上报道了SPATA6蛋白缺失可导致小鼠“无头”精子症发生,并证实SPATA6是精子头颈链接部(connecting piece)的重要组成蛋白。但这一研究并未解析精子头-尾分离的具体分子调控网络。
2024年3月7日,华中科技大学同济医学院生殖健康研究所袁水桥教授团队在国际著名期刊EMBO Reports上以“BAG5 regulates HSPA8-mediated protein folding required for sperm head-tail coupling apparatus assembly”为题发表了一项原创性研究成果。该研究发现精子HTCA异常组装导致“无头精子”症的致病新机制,揭示了BAG5蛋白与SPATA6蛋白互作激活热休克家族蛋白HSPA8介导的蛋白折叠网络,进而调节精子头尾耦合装置的组装。

为研究新鉴定的SPATA6互作蛋白BAG5的生理功能,课题组首先利用CRISPR/Cas9技术构建了Bag5敲除小鼠模型,发现BAG5蛋白缺失可导致雄性小鼠不育,进一步的表型分析发现Bag5敲除小鼠附睾精子头尾分离,呈现“无头精子”症状,与Spata6敲除小鼠表型一致。接下来,课题组通过透射电镜(Transmission electron microscope,TEM)对敲除小鼠精子变形过程进行详细观察(step by step),发现从第6-8步(step 6-8)开始精子HTCA组装开始出现异常,至step 15-16精子头尾完全分离,表明BAG5蛋白对精子变形中HTCA的组装有重要的调控作用。有趣的是,课题发现通过卵胞浆内单精子注射(Intracytoplasmic sperm injection,ICSI)辅助生殖技术,Bag5敲除小鼠分离的精子头具有正常的受精能力,这对于未来寻找人群中Bag5基因突变导致男性不育的诊断和治疗具有重要的临床意义。
机制研究方面,课题组结合以往的研究,提出BAG5蛋白通过介导伴侣蛋白HSPA8的蛋白折叠功能,参与精子HTCA组装的分子假设。通过一序列的体内外实验,课题组发现BAG5蛋白的BD5结构域和HSPA8蛋白的NBD结构域相互作用,调控HSPA8蛋白的SBD结构域与底物蛋白的亲和力。进一步通过免疫共沉淀(Co-IP)实验,发现在野生型小鼠睾丸组织中,HSPA8蛋白与SPATA6、MYO5A和DYNLT1蛋白有较为强烈的相互作用效应,而在Bag5敲除小鼠睾丸组织中,这些相互作用显著减弱,表明BAG5蛋白能够增强HSPA8蛋白复合物的稳定性,以调节HSPA8与靶蛋白(SPATA6、MYO5A和DYNLT1)的亲和力。接下来,课题组通过非靶向定量蛋白质组学(Untargeted quantitative proteomics)以及免疫印记实验证实了BAG5蛋白缺失影响SPATA6蛋白、肌球蛋白(MYO5A和MYL6)和动力蛋白(DYNLT1、DCTN1和DNAL1)的蛋白折叠和蛋白稳态。此外,该研究还发现,体内外ATP和非水解ATP类似物(AMP-PNP)均可以影响HSPA8与SPATA6的结合,同时HSPA8的核苷酸结合域NBD的破坏可降低HSPA8的SBD结构域与SPATA6蛋白的结合能力。总之,该研究通过一系列的体内外实验,揭示了精子头尾耦合装置(HTCA)形成过程中一个创新性的蛋白质调节网络(BAG5-HSPA8-SPATA6),进一步完善了精子HTCA形成的具体分子机制(图1)。
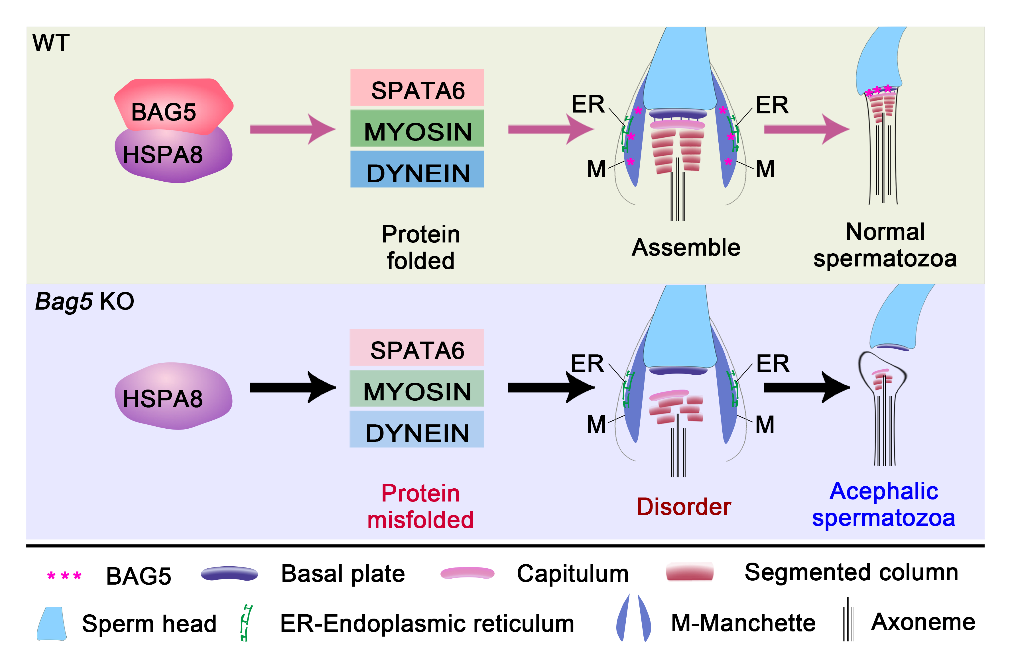
图1. BAG5蛋白激活HSPA8介导的蛋白折叠参与精子颈部组装的分子模式图。
华中科技大学同济医学院生殖健康研究所博士研究生甘世明、浙江大学邵逸夫医院博士研究生周淑敏、华中科技大学基础医学院博士研究生马金哲、同济医学院生殖健康研究所博士毕业生熊孟能(现就职于武汉大学人民医院生殖中心)为该论文的共同第一作者,华中科技大学同济医学院生殖健康研究所/实验动物中心袁水桥教授为该论文的唯一通讯作者。该研究得到了华中科技大学基础医学院马梅生教授、美国加州大学洛杉矶分校闫威教授以及浙江大学邵逸夫医院孙斐教授大力支持,以及国家自然科学基金项目、华中科技大学基础研究计划的经费支持。
论文链接:https://doi.org/10.1038/s44319-024-00112-x










 English
English


